El primer principio de la termodinámica o primera ley de la termodinámica,[1] se postula a partir del siguiente hecho experimental:
En un sistema cerrado adiabático (aislado) que evoluciona de un estado inicial  a otro estado final
a otro estado final 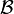 , el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.
, el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.
 a otro estado final
a otro estado final 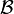 , el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.
, el trabajo realizado no depende ni del tipo de trabajo ni del proceso seguido.Más formalmente, este principio se descompone en dos partes;
- El «principio de la accesibilidad adiabática» El conjunto de los estados de equilibrio a los que puede acceder un sistema termodinámico cerrado es, adiabáticamente, un conjunto simplemente conexo.
- y un «principio de conservación de la energía»: El trabajo de la conexión adiabática entre dos estados de equilibrio de un sistema cerrado depende exclusivamente de ambos estados conectados.
Este enunciado supone formalmente definido el concepto de trabajo termodinámico, y sabido que los sistemas termodinámicos sólo pueden interaccionar de tres formas diferentes (interacción másica, interacción mecánica e interacción térmica). En general, el trabajo es una magnitud física que no es una variable de estado del sistema, dado que depende del proceso seguido por dicho sistema. Este hecho experimental, por el contrario, muestra que para los sistemas cerrados adiabáticos, el trabajo no va a depender del proceso, sino tan solo de los estados inicial y final. En consecuencia, podrá ser identificado con la variación de una nueva variable de estado de dichos sistemas, definida como energía interna.
Se define entonces la energía interna, U,como una variable de estado cuya variación en un proceso adiabático es el trabajo intercambiado por el sistema con su entorno:
Cuando el sistema cerrado evoluciona del estado inicial A al estado final B pero por un proceso no adiabático, la variación de la Energía debe ser la misma, sin embargo, ahora, el trabajo intercambiado será diferente del trabajo adiabático anterior. La diferencia entre ambos trabajos debe haberse realizado por medio de interacción térmica. Se define entonces la cantidad de energía térmica intercambiada Q (calor) como:
Esta definición suele identificarse con la ley de la conservación de la energía y, a su vez, identifica el calor como una transferencia de energía. Es por ello que la ley de la conservación de la energía se utilice, fundamentalmente por simplicidad, como uno de los enunciados de la primera ley de la termodinámica:
La variación de energía de un sistema termodinámico cerrado es igual a la diferencia entre la cantidad de calor y la cantidad de trabajo intercambiados por el sistema con sus alrededores.
En su forma matemática más sencilla se puede escribir para cualquier sistema cerrado:
donde:
 es la variación de energía del sistema,
es la variación de energía del sistema,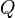 es el calor intercambiado por el sistema a través de unas paredes bien definidas, y
es el calor intercambiado por el sistema a través de unas paredes bien definidas, y es el trabajo intercambiado por el sistema a sus alrededores.
es el trabajo intercambiado por el sistema a sus alrededores.
Historia
Durante la década de 1840, varios físicos entre los que se encontraban Joule, Helmholtz y Meyer, fueron desarrollando esta ley. Sin embargo, fueron primero Clausius en 1850 y Thomson (Lord Kelvin) un año después quienes escribieron los primeros enunciados formales.[2] [3]
Descripción
La forma de transferencia de energía común para todas las ramas de la física -y ampliamente estudiada por éstas- es el trabajo.
Dependiendo de la delimitación de los sistemas a estudiar y del enfoque considerado, el trabajo puede ser caracterizado como mecánico, eléctrico, etc. pero su característica principal es el hecho de transmitir energía y que, en general, la cantidad de energía transferida no depende solamente de los estados iniciales y finales, sino también de la forma concreta en la que se lleven a cabo los procesos.
El calor es la forma de transferencia de un tipo de energía particular, propiamente termodinámica, que es debida únicamente a que los sistemas se encuentren a distintas temperaturas (es algo común en la termodinámica catalogar el trabajo como toda trasferencia de energía que no sea en forma de calor). Los hechos experimentales corroboran que este tipo de transferencia también depende del proceso y no sólo de los estados inicial y final.
Sin embargo, lo que los experimentos sí demuestran es que dado cualquier proceso de cualquier tipo que lleve a un sistema termodinámico de un estado A a otro B, la suma de la energía transferida en forma de trabajo y la energía transferida en forma de calor siempre es la misma y se invierte en aumentar la energía interna del sistema. Es decir, que la variación de energía interna del sistema es independiente del proceso que haya sufrido. En forma de ecuación y teniendo en cuenta el criterio de signos termodinámico esta ley queda de la forma:
Así, la Primera Ley (o Primer Principio) de la termodinámica relaciona magnitudes de proceso (dependientes de éste) como son el trabajo y el calor, con una variable de estado (independiente del proceso) tal como lo es la energía intern

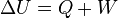
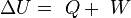
No hay comentarios:
Publicar un comentario